Rendezvénynaptár 
-
január 16.13:00 - 15:00
-
január 19.10:30 - 12:30
Sajtóanyag letöltése (PDF formátum)
Nagyfeloldású lokalizációs mikroszkópia,
avagy a „sok kicsi sokra megy” igaz története
Napjainkban az optikai mikroszkópia egyik fontos kutatási iránya a molekuláris szintű folyamatok követése biológiai rendszerekben, lehetőleg valós időben. Ehhez elengedhetetlen a feloldóképesség javítása és így minél finomabb struktúrák leképezése, láthatóvá tétele. A klasszikus optikai mikroszkópiában a feloldóképességet a diffrakció limitálja. A még éppen feloldható két pontszerű objektum távolsága a Rayleigh-kritérium alapján adható meg, amely oldalirányban tipikusan 200-300 nanométer, tengelyirányban pedig 500 nanométer. Ez azt jelenti, hogy egy ilyen paraméterekkel jellemzett tartományon belül nem oldható fel a minta struktúrája.
Ezt a korlátot az elmúlt években néhány fluoreszcens mikroszkópiai eljárással sikerült megkerülni, tulajdonképpen kijátszani. Ezek a technikák lehetővé tesznek néhányszor tíz nm-es térbeli feloldást, versenyre kelve ezzel a pásztázó elektronmikroszkóppal. Ezeket a technikákat nagyfeloldású optikai mikroszkópiai technikáknak (superresolution microscopy) nevezzük. Legnagyobb előnyük, hogy optikai tartományban működnek, és nem igényelnek speciális mintaelőkészítést, ellentétben az elektronmikroszkóppal – a mintaroncsolást ilyen módon minimalizálni lehet. Néhány példa, a teljesség igénye nélkül: strukturált kivilágítással működő mikroszkóp (Structured Illumination Microscopy (SIM)[1, 2]), stimulált emissziós kioltást használó mikroszkóp (Stimulated Emission Deplention Microscopy (STED) [3]), 4PI mikroszkópia [4], illetve a lokalizációs elven működő mikroszkópok.
A lokalizációs mikroszkópiai technika 2006-ban látott napvilágot, amikor három kutatócsoport közel egy időben publikálta a módszert. Azóta rohamos fejlődésnek indult és töretlen népszerűségnek örvend mindmáig, egyszerűsége és szuperfeloldása miatt. Mindhárom kifejlesztett lokalizációs mikroszkóp (STORM [5], PALM [6], FPALM [7]) ugyanazt az alapötletet használja: míg a hagyományos mikroszkópiai technikában sok festékmolekula együtt világít, nincsenek szeparálva időben, addig itt fotokémiai folyamatok révén lehetővé válik, hogy csak bizonyos mennyiségű molekula világítson, legyen aktív állapotban egyszerre (kapcsolhatóvá válnak a molekulák) (1. ábra (b)).
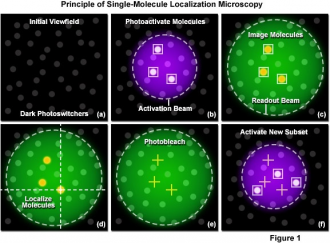
1. ábra: A lokalizációs mikroszkópia képalkotásának egy ciklusa [8]
Ezeket az egyes molekulákat leképezzük és detektáljuk nagy érzékenységű EMCCD kamerával (1. ábra (c)). A kapott kép olyan, mintha néhány, világító szentjánosbogarat fényképeztünk volna le. Függvényillesztéssel képük alapján meghatározhatóak az egyes festékmolekulák pozíciói (1. ábra (d)). Ezt a metódust sokszor (akár több ezerszer) ismételve, mindig más különálló molekulákat bekapcsolva és lokalizálva a minta képe rekonstruálható az egyes festékmolekulák pozíciói alapján. A rekonstrukció során egy térképen megjelöljük az összes kapott (akár több tízezer) pozíciót. A mérés során tulajdonképpen időben szeparáljuk és vezényeljük a festékmolekulák fotonkibocsátását – így a feloldott struktúra aprólékos munkával, fokozatosan alakul ki.
Ez a technika 10-20 nm-es feloldást tesz lehetővé. A 2. ábrán látható egy amiloid fehérjékből álló, megfestett szálakat tartalmazó mintáról hagyományos (a) és lokalizációs (b) mikroszkóppal készült kép. Az ábra (c) részén két olyan szál látható, amelynek távolsága kisebb, mint a diffrakció által megszabott határ – a lokalizációs mikroszkóp mégis fel tudja oldani.

2 ábra: Egy hagyományos (a) és lokalizációs (b) mikroszkóppal készült kép összehasonlítása, két szál távolsága (c) [9]
A Nagyfeloldású Optikai Mikroszkópia kutatócsoportunk (Advanced Optical Imaging Group) fő kutatási területe a nagy térbeli feloldású optikai mikroszkópiai technikák fejlesztése (algoritmusok fejlesztése, technikák kombinálása, új technikák kidolgozása stb.) és alkalmazása, elsősorban a biológiában és az orvostudományban. Célunk többek között, hogy a közeljövőben meghonosítsuk Szegeden a lokalizációs mikroszkópiai technikát és továbbfejlesszük azt.
Sinkó József, Dr. Kákonyi Róbert, Dr. Erdélyi Miklós
SZTE TTIK Optikai és Kvantumelektronikai Tanszék
További információ: adoptim@titan.physx.u-szeged.hu
Nemzetközi együttműködéseink:
Laser Analytics, University of Cambridge, Department of Chemical Engineering and Biotechnology, UK
Biophysics and Diagnostics, National Physical Laboratory, UK
Támogatók:
A kutatás a TÁMOP 4.2.4.A/2-11-1-2012-0001 azonosító számú „Nemzeti Kiválóság Program – Hazai hallgatói, illetve kutatói személyi támogatást biztosító rendszer kidolgozása és működtetése konvergencia program” című kiemelt projekt keretében zajlik. A projekt az Európai Unió támogatásával, az Európai Szociális Alap társfinanszírozásával valósul meg.
Hivatkozások:
1. Gustafsson, M.G.: Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy, J Micr 198:82-87 (2000)
2. Gustafsson, M.G.L.: Nonlinear structured-illumination microscopy: wide-field fluorescence imaging with theoretically unlimited resolution, Proc. Natl. Acad. Sci. USA 102, 13081–13086 (2005)
3. Westphal, V.; S. O. Rizzoli, M. A. Lauterbach, D. Kamin, R. Jahn, S. W. Hell (2008). Science 320: 246–249.
4. S.W. Hell, E.H.K. Stelzer, S. Lindek, C. Cremer (1994). "Confocal microscopy with an increased detection aperture: type-B 4Pi confocal microscopy". Optics Letters 19 (3): 222–224.
5. M. J. Rust, M. Bates, X. Zhuang, "Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM)", Nature Methods 3, 793-795 (2006)
6. Betzig, E.; et al. (2006). "Imaging Intracellular Fluorescent Proteins at Nanometer Resolution". Science 313 (5793): 1642–1645
7. Hess, S.; T. Giririjan, M. Mason (2006). "Ultra-High Resolution Imaging by Fluorescence Photoactivation Localization Microscopy". Biophysical Journal 91 (11): 4258–4272
8. http://zeiss-campus.magnet.fsu.edu/articles/superresolution/palm/practicalaspects.html
9. Kaminski Schierle, G. S., Van De Linde, S., Erdelyi, M., Esbjörner, E. K., Klein, T., Rees, E., Bertoncini, C. W., et al. (2011). In Situ Measurements of the Formation and Morphology of Intracellular β-Amyloid Fibrils by Super-Resolution Fluorescence Imaging. Journal of the American Chemical Society, 133(33), 12902-5. Elsevier Ltd.
Intézetek
AZ EGYETEMRŐL
HASZNOS OLDALAK
